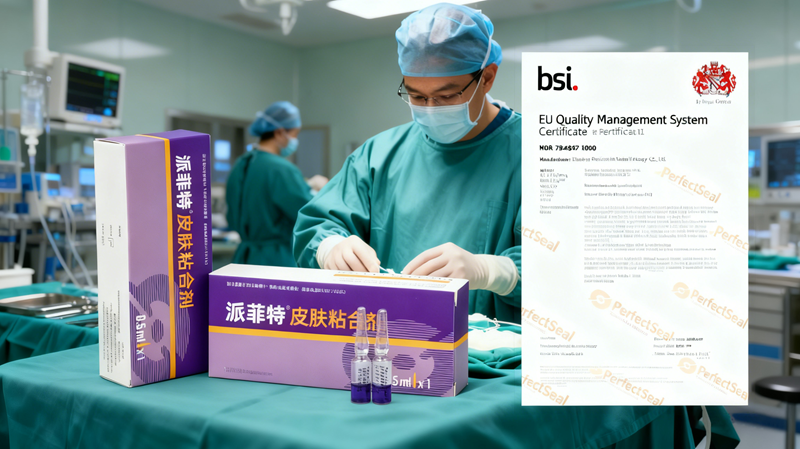
作为一家经验丰富的医用外科皮肤胶水生产厂家,我们一直致力于为医疗行业提供高品质、安全可靠的医用皮肤胶水产品。我们很荣幸地宣布,我司生产的医用外科胶水在获得MDD证书的基础上,又率先取得了MDR 证书,成为国内首家获得该证书的医用外科皮肤胶水企业。
MDD与MDR有着诸多区别,主要区别如下:
对比维度 | MDD(医疗器械指令 93/42/EEC) | MDR(医疗器械法规 EU 2017/745) |
法律性质 | 指令,需成员国转化为国内法,执行存在差异 | 法规,欧盟全域直接生效,执行标准完全统一 |
生效与替代时间 | 1993 年实施,2021 年被取代,旧证书最晚 2024 年 5 月失效 | 2017 年发布,2021 年 5 月强制执行,全面替代 MDD |
监管适用范围 | 覆盖传统医疗器械,边缘品类未明确纳入 | 范围扩大,含美容设备、医疗软件等,明确纳入高风险边缘品类 |
临床评价要求 | 允许文献 / 等效产品数据,原创临床试验要求宽松 | 强制原创临床试验 + 实证数据,临床证据审核更严格 |
符合性评估方式 | 低风险产品可企业自我声明,审核流程简化 | 全风险等级审核收紧,高风险产品需公告机构深度审核 + 现场检查 |
售后监管机制 | 上市后监督基础,无强制追溯要求 | 强制 UDI 唯一标识追溯,需主动开展 PMS 上市后监控 + 趋势报告 |
经济运营者责任 | 角色职责划分模糊,追责机制不明确 | 明确制造商 / 授权代表等四大主体义务,全链条追责,违规成本提升 |
技术文件要求 | 仅需基础技术文档,满足基本合规证明 | 需涵盖临床数据、风险管理、PMS 记录等,文档需实时更新 |
违规处罚力度 | 处罚较轻,多为整改、通报 | 高额罚款、强制召回、限制市场准入,威慑力极强 |
对比维度 | MDD(医疗器械指令 93/42/EEC) | MDR(医疗器械法规 EU 2017/745) |
我司医用皮肤伤口胶水获得MDR 证书,意味着我们的产品在安全性、有效性和质量控制等方面达到了更高的标准,能够更好地满足医疗市场的需求。这不仅是对我们产品质量和研发实力的肯定,也为我们在全球市场上的竞争力增添了重要砝码。
我们深知医用外科皮肤胶水在医疗手术中的重要性,因此始终坚持以严格的质量管理体系和先进的生产技术,确保每一瓶医用手术胶水都符合最高标准。我们的专业团队拥有丰富的行业经验,能够根据不同客户的需求,提供定制化的医用胶水解决方案,满足各种手术场景的应用。
目前,我们正面向全国招商,诚邀有志于医用外科皮肤组织胶水领域的合作伙伴加入我们。无论您是医疗器械经销商、医疗机构还是相关企业,我们都期待与您携手合作,共同开拓医用胶水市场,为医疗事业贡献力量。
我们相信,凭借我们的专业实力和优质产品,以及您的市场渠道和资源,我们一定能够实现互利共赢,共创美好未来。如有合作意向,请随时联系我们,我们将为您提供详细的产品资料、市场支持和合作方案。

让我们一起,为医疗手术的成功保驾护航,为患者的生命健康提供坚实保障!





